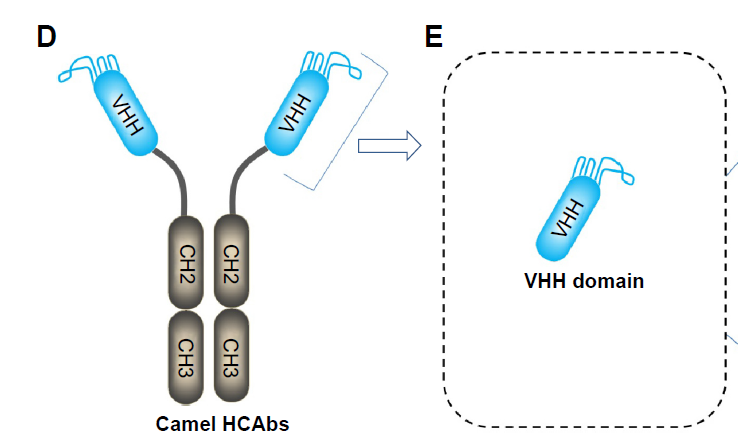
在骆科动物体存在传统的”Y”型抗体和重链抗体(HCAbs, Heavy-Chain Antibodies)。骆驼血清中HCAbs和常规 IgG 的百分比是不同的:在骆驼中,比例可达到 50-80%,而在南美骆驼科物种中只有 10-25%。这种差异与它们的遗传背景有关。
从结构上看,HCAbs包含一个重链可变区(VHH)、一个铰链区和两个常规的CH2和CH3区域,分子量大约为90kDa。
在基因水平,一些B细胞中,IGHV3H与D和J基因重排形成VHH结构域,最终与HCAb专门的IGHG2(或IGHG3)基因共表达。在mRNA剪接阶段,CH1区域被切除,最终形成HCAbs。
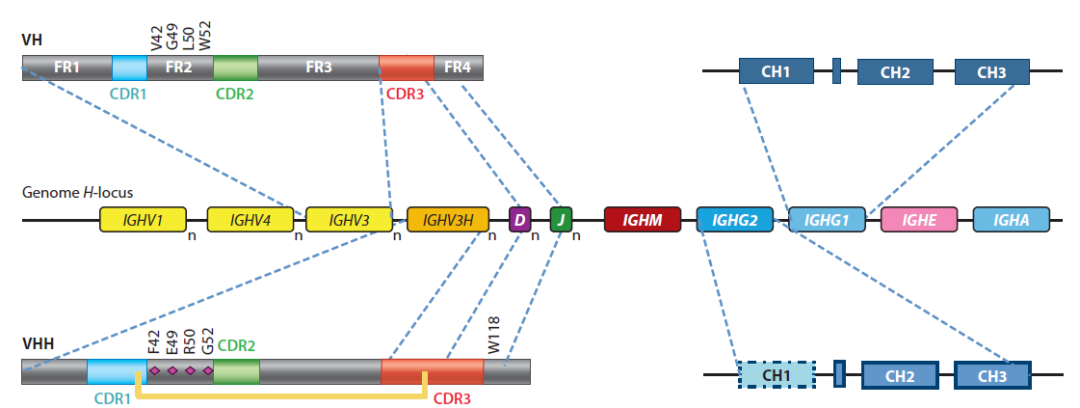
纳米抗体(Nanobody, Nb或VHH)是仅含有VHH区域片段的重链单域抗体。它是由驼科动物(骆驼、大羊驼、羊驼及其近亲物种)重链可变区构成。纳米抗体晶体直径为2.5nm,长4nm,分子量大约为12-15KD。
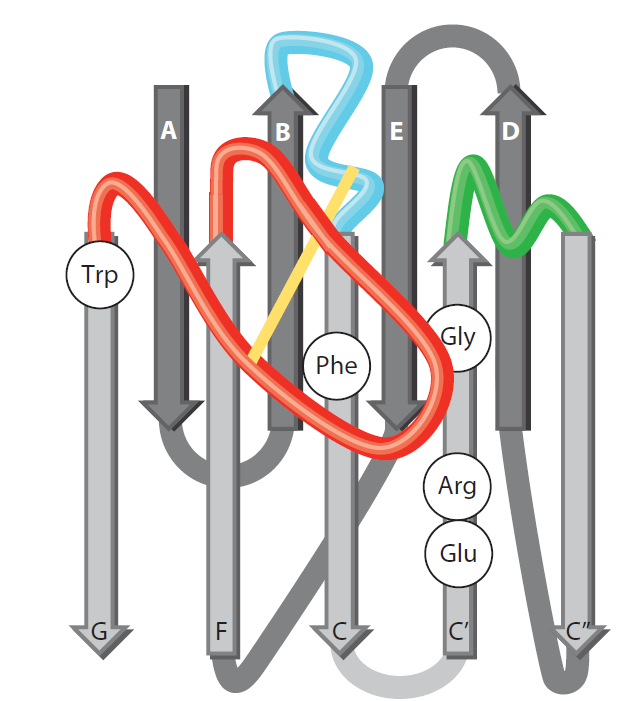
纳米抗体V区序列变化较高的区域是高变区(Hypervariable Regions,HV),纳米抗体的三个HV由相对保守的区域(Conserved Framework,FR)包围。从图2的空间结构来看,V区由9个β片段(A-B-C-C’-C’’-D-E-F-G)组成,其中四个组成一组β折叠,另外5个组成另一组β折叠。两组折叠由β片段之间的环状结构和二硫键链接(保守的Cys23和Cys94形成)。在这种结构中,HV位于链接B-C、C’-C’’、F-G链的H1到H3(图中蓝色、绿色、红色标注)的位置。结构域N末端的氨基酸簇形成连续VHH的FR和HV区域的结构类似于VH,但是在FR2和CDRs区域两者有明显区别。在常规抗体的FR2区域中有高度保守的疏水性氨基酸(Val47、Gly49、Leu50、Trp52),这些氨基酸与轻链可变区的结合有关。但是在VHH中,这些氨基酸替换成更小的氨基酸和/或亲水性氨基酸(Phe42、Glu49、Arg50、Gly52)。经过这种替换后,VHH不能与VL相互作用,且协助VHH在VL不存在的情况下保持抗体的亲水性(不粘性),并且降低VHH的聚合。VH与VHH的另外一个区别在HV环。VHH的CDR1和CDR3区域有更长的HV区域,这些更长的区域形成了更高效的抗原作用界面,大约在600-800Å2,可与IgG抗体提供的空间大小相似。延长的CDR3能够延伸到抗原的空腔中,例如酶的活性位点缝隙和受体的配体结合空腔。但是,扩大的CDR区域也有更高的灵活性这种灵活性也会对抗原抗体的结合产生负面影响。在VHH中,CDR3和CDR1或CDR2甚至FR2形成的二硫键可解决这种问题。同时,这些二硫键可以最大程度优化结合位点的拓扑结构并且促进CDR3朝向抗原的方向。性强。
纳米抗体用于生物医药研发(基因工程药物研发、ADC药物研发)、临床体外诊断(胶体金法、酶联免疫吸附法、电化学发光法)、肿瘤研究、免疫学研究等。
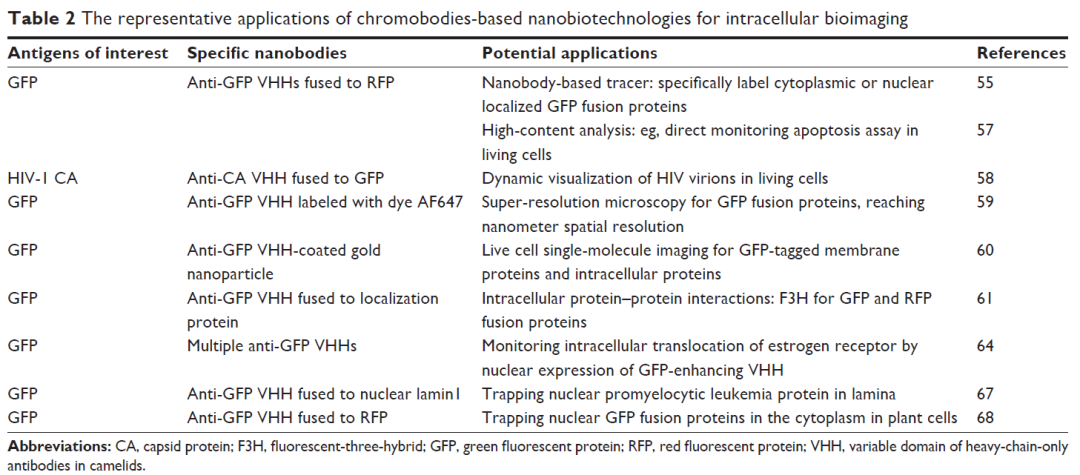
VHH在细胞内的应用
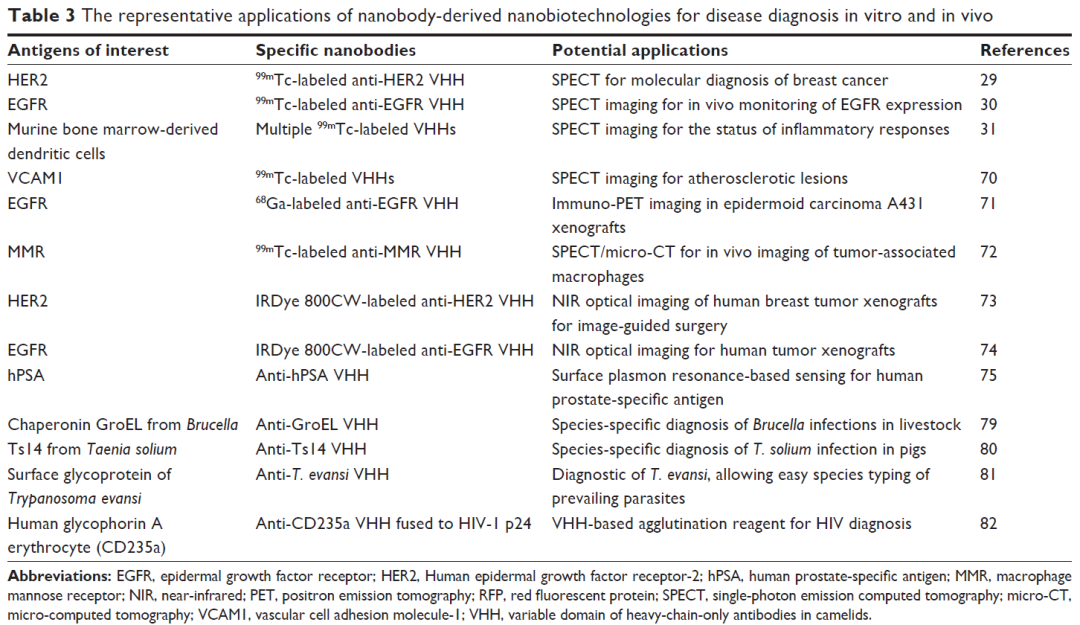
VHH在诊断方向的应用
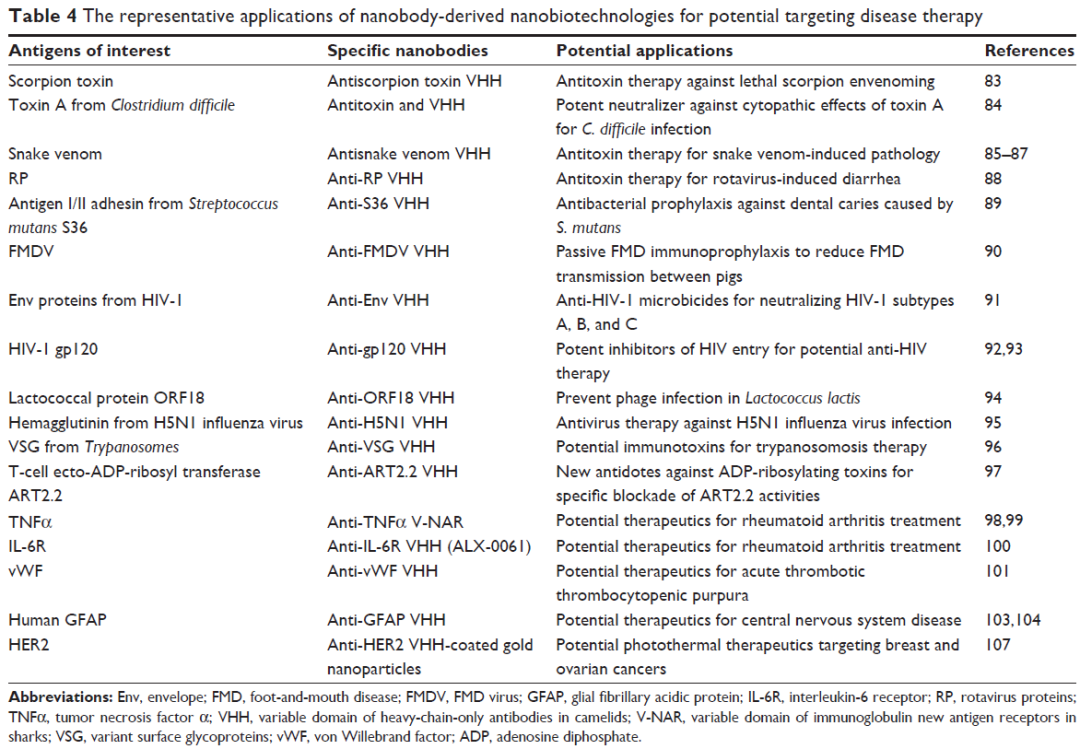
VHH在疾病治疗方向的应用
纳米抗体优势总结
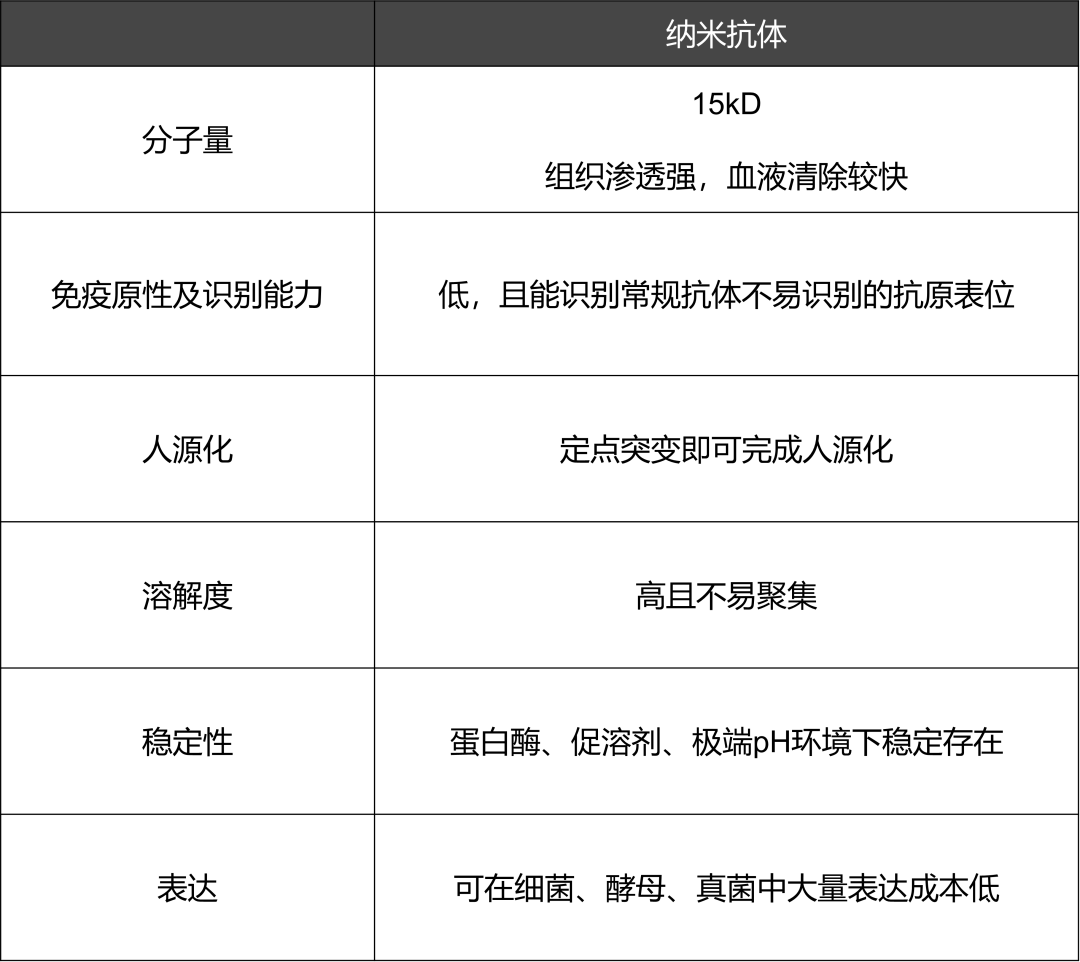
 百英生物自主开发的新一代
百英生物自主开发的新一代
Copyright © 2022-2030 武汉瑾萱生物科技有限公司 版权所有 地址:武汉东湖新技术开发区光谷三路777号自贸生物创新港B区(生物医药平台检验研发楼) 备案号:鄂ICP备2022008796号 网站地图